Influenza aviaire de quoi parle-t-on ?

Les virus de l’influenza aviaire (VIA ; aussi appelés virus des grippes aviaires) circulent probablement depuis des millénaires au sein de leur réservoir que sont les oiseaux d’eau, en particulier les Anatidés (oies, canards, cygnes etc.) et les Laridés (mouettes, goélands, sternes etc.). Ils sont extrêmement diversifiés. En effet, on connait aujourd’hui chez les oiseaux 16 types d’hémagglutinine (H) et neuf types de neuraminidase (N), les deux protéines de surface qui servent à classifier les VIA en ce que l’on appelle des sous-types. Parmi ces sous-types, la plupart sont faiblement pathogènes (FPAIV), c’est-à-dire qu’ils causent pas ou peu de symptômes chez les individus qui les portent. En revanche, les sous-types H7 et H5 peuvent muter pour devenir hautement pathogènes (HPAIV). Leur virulence est alors forte et ils peuvent causer d’importants épisodes de mortalité en élevage comme en faune sauvage.
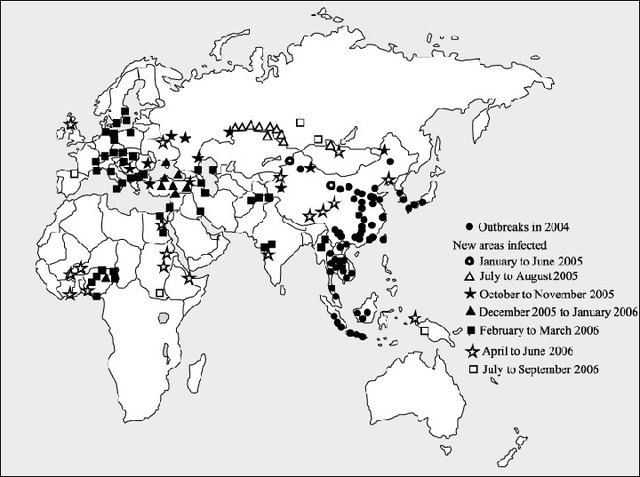
Historiquement, les épisodes de transmission d’HPAIV ont commencé à créer des inquiétudes lorsqu’ils ont causé de fortes pertes dans les élevages de canards, puis de poulets au milieu des années 1990 en Asie du Sud-Est. Au sein de l’immense réservoir très favorable à leur maintien et à leur diffusion qu’étaient ces élevages, les souches H5N1 hautement pathogènes ont commencé à se diversifier et à se propager sur le continent asiatique. C’est au cours de l’hiver 2005-2006 que cette propagation a atteint l’Europe, en passant par les voies commerciales reliant l’Asie à l’Europe via la Russie (Gauthier-Clerc et al. 2007). S’en sont suivis de nombreux cas dans des élevages, qui ont ensuite atteint plusieurs pays africains, dont l’Egypte et le Nigeria, du fait notamment des importations de poussins destinés aux élevages industriels. En Europe, la propagation a continué vers l’Ouest, en partie relayée par des mouvements d’oiseaux sauvages hivernants poussés par une vague de froid de l’Est à l’Ouest de l’Europe.
Quelles modalités de diffusion au sein des populations humaines, des élevages et de la faune sauvage ?
Pendant toute cette période, les enjeux principaux associés à la circulation des HPAIV étaient économiques : (i) mortalités et abattages dans les élevages et (ii) coûts associés aux mesures de biosécurité à mettre en œuvre. De vives inquiétudes se sont également manifestées à l’arrivée des premières souches H5N1 HPAIV en Europe vis-à-vis de la santé publique. A l’échelle mondiale, quelques centaines de cas humains d’infection à H5N1 (861 reportés à l’OMS) dont 455 mortels ont été reportés de 2003 à 2019.
Néanmoins, fort heureusement, jusqu’à aujourd’hui, les souches H5N1 n’ont pas acquis la capacité à se transmettre de façon pérenne d’humain à humain. La grande majorité des cas humains a été associée à des transmissions d’oiseau d’élevage à humain et le nombre de cas a été très limité par rapport aux chiffres alarmants craints au début de la circulation du virus. De même, au tout début de cet épisode de circulation de 2005-2006, la forte mortalité observée sur les oies à tête barrée (Anser indicus) du lac Qinghai, en Chine, avait fait craindre de forts impacts sur la faune sauvage. Une partie de ces oies se sont révélées être semi-domestiques puisque nourries pour être vendues et les enjeux de conservation associés à la circulation des HPAIV sont longtemps restés faibles.
Quelle situation en France et quelle implication de la Tour du Valat dans les recherches sur la circulation de l’Influenza aviaire dans la faune sauvage de 2006 à 2020 ?
La Tour du Valat a fait partie, dès 2006, des organismes de recherche qui ont contribué à mieux comprendre les dynamiques des VIA chez les oiseaux sauvages. Les travaux menés dans le cadre du doctorat de Camille Lebarbenchon ont notamment permis de montrer qu’en Camargue les principales espèces impliquées dans la circulation des VIA étaient le canard colvert (Anas plathyrynchos) et la sarcelle d’hiver (Anas crecca). Les passereaux ou les ardéidés, tout comme les flamants roses, étaient quant à eux très rarement porteurs de ces virus. Parmi les 51 souches de VIA isolées en 2006-2007 en Camargue, aucune n’était hautement pathogène.

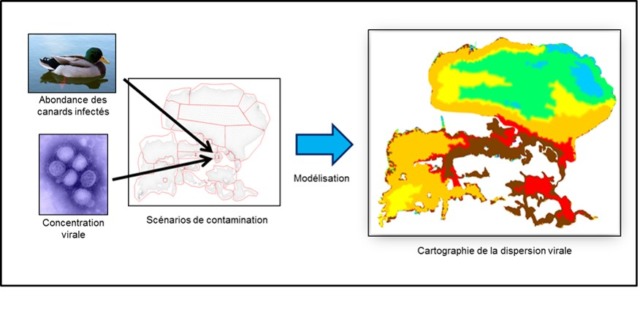
Par la suite, au cours du doctorat de Marion Vittecoq, la présence régulière mais chez une faible proportion d’individus de VIA faiblement pathogènes a été montrée chez les Laridés en Camargue notamment chez le goéland leucophée (Larus michahellis). Plus récemment, la circulation dans l’eau des VIA en Camargue a été modélisée. En effet, chez les oiseaux sauvages, l’eau joue un rôle majeur dans la transmission des VIA. Cette modélisation a mis en évidence la grande hétérogénéité des concentrations potentielles de VIA en fonction des différentes zones du delta. Les plus fortes concentrations sont attendues dans la partie centrale qui couple zones de faible profondeur et forte présence en hiver des oiseaux appartenant aux espèces considérées comme réservoirs des VIA (Vittecoq et al. 2017). Ces travaux ont été menés en vue d’optimiser à l’avenir la surveillance des VIA en amont et durant d’éventuelles crises.
En France, après une période d’absence de détection d’HPAIV de 2008 à 2014, les crises touchant les élevages se sont succédées depuis 2015. Elles ont jusqu’en 2020 essentiellement touché les élevages de canards gras du Sud-Ouest. Ainsi en 2016-2017 ce sont 92 foyers qui ont été dénombrés en élevage, avec de lourdes pertes économiques associées. Ces crises étaient liées à la circulation de différentes souches H5 hautement pathogènes (H5N1, H5N2, H5N6, H5N8, H5N9). Ces dernières étaient également couramment retrouvées au sein de la faune sauvage en Europe de l’Ouest, notamment chez des rapaces et des Laridés. En Europe, en 2016-2017, 58 espèces d’oiseaux sauvages porteuses d’HPAIV avaient ainsi été dénombrées. Toutefois ces circulations n’avaient pas été associées à des mortalités massives en faune sauvage.
En France, il avait été montré en 2016-2017 que les souches H5N8 d’HPAIV étaient arrivées lors de la migration postnuptiale de fin d’automne des anatidés. Au cours de cette saison, un nombre limité (de l’ordre d’une dizaine) d’évènements de passage des oiseaux sauvages aux oiseaux domestiques a été suivi de l’explosion du nombre de foyers en élevage associée aux contacts existants au sein de la filière d’élevage. On assiste ainsi depuis plusieurs années à des échanges réguliers de souches HPAIV entre faune sauvage et faune domestique.
Cependant, jusqu’en 2020, les mortalités étaient essentiellement observées dans les élevages. Ceux-ci étaient considérés comme clairement plus favorables au maintien et à la dispersion de ces souches du fait des leurs interconnexions multiples, des fortes densités d’oiseaux présents et de leur forte homogénéité génétique. En 2015, une première alerte avait néanmoins été donnée par les fortes mortalités observées sur les colonies de pélicans frisés (Pelecanus crispus) en Bulgarie et en Roumanie dues à la circulation de souches H5N1 (Stoimenov, Goujgoulova & Hristov, 2015).
La faune sauvage touchée de plein fouet
Depuis 2021, on assiste à l’extension d’une nouvelle crise qui touche cette fois de plein fouet la faune sauvage. Cette crise est associée à la circulation de plusieurs souches H5N1 HPAIV à la fois en élevage et au sein de la faune sauvage. Du côté domestique, en plus des élevages de canards gras, on a observé cette année de nombreux foyers dans les élevages de poules pondeuses et de poulets de chair sur toute la façade Ouest en France, pour un total national de 1378 élevages commerciaux touchés entre août 2021 et juin 2022.

En 2022, au sein de la faune sauvage des mortalités inhabituelles ont été observées chez plusieurs espèces d’oiseaux marins et de rapaces incluant notamment les fous de bassan (Morus bassanus, voir l’entretien), les vautours fauves (Gyps fulvus), les sternes caugek (Thalasseus sandvicensis) ou encore les pélicans frisés (Pelecanus crispus, voir « aller plus loin » ci-dessous). Ces observations ont eu lieu en France mais aussi dans de nombreux autres pays européens ainsi qu’en Amérique du Nord. Ces mortalités sont imputables aux circulations simultanées de souches H5N1 hautement pathogènes en Europe et en Amérique du Nord. L’Afrique est aussi touchée avec des mortalités observées jusqu’en Afrique du Sud sur des manchots du Cap (Spheniscus demersus) (Dewar et al. 2022).
Que nous réserve l’avenir ?
D’un point de vue de conservation la situation actuelle de la circulation des virus HPAIV est tout à fait inédite. Comme l’explique dans l’entretien de ce dossier, Pascal Provost, conservateur de la réserve naturelle nationale des Sept-Iles en Bretagne, où des milliers de fous de Bassan sont morts cette année, l’heure est au bilan et à l’adaptation des suivis. De plus, de vives inquiétudes existent quant aux éventuels impacts sur des espèces qui n’ont pas encore été touchées telles que les albatros, qui pourraient être dans les prochains mois en contact avec d’autres oiseaux marins porteurs.
Des directives ont déjà été passées, notamment dans les équipes travaillant dans les terres australes et antarctiques françaises (TAAF), pour éviter que les suivis scientifiques ne participent à la contamination des populations étudiées (nettoyage du matériel et des tenues entre les colonies etc.). Par ailleurs le réseau SAGIR coordonné par l’Office Français de la Biodiversité (OFB), qui est en charge du suivi des mortalités inhabituelles au sein de la faune sauvage en France, reste le référent en cas de découverte d’oiseaux morts. En général on considère qu’à partir de 3 oiseaux retrouvés dans un contexte pouvant faire penser à une contamination par l’influenza aviaire, il convient de contacter le réseau (https://www.ofb.gouv.fr/le-reseau-sagir).
Gestionnaires d’espaces naturels, scientifiques et acteurs de la santé humaine et vétérinaire sont ainsi appelés à poursuivre leurs travaux en commun dans les prochains mois afin de suivre et comprendre au mieux la situation et ses implications en termes de conservation à moyen et long terme, dans un contexte où les souches de HPAIV semblent devenir endémiques, avec un risque accru de crises récurrentes. Comme elle l’a fait depuis la détection des premiers cas de H5N1 HPAIV en France il y a plus de 15 ans, la Tour du Valat continuera à s’engager activement dans ces travaux à l’interface entre science et gestion.
Acronymes
|
Contact : Marion Vittecoq (e-mail) , chargée de recherche, coordinatrice du thème Écologie de la Santé.
References
Dewar M.L., Wille M., Gamble A.,Vanstreels R.,Boulinier T., Smith A., Varsani A., Ratcliffe N., Black J. and Lynnes A. 2022 The Risk of Avian Influenza in the Southern Ocean : A practical guide. Ecoevorxiv
Gauthier-Clerc M., Lebarbenchon C., Thomas F. 2007. Recent expansion of highly pathogenic avian influenza H5N1: a critical review. International Journal of Avian Science 149(2) :202-214
Stoimenov G, Goujgoulova G, Hristov K (2020): Analysis of a highly pathogenic avian influenza (H5N1) virus causing the first outbreak in domestic poultry in Bulgaria in January 2015. Vet Med-Czech 65, 435–444.
Vittecoq M., Gauduin H., Oudart T., Bertrand O., Roche B., Guillemain M., Boutron O. 2017. Modeling the spread of avian influenza viruses in aquatic reservoirs: A novel hydrodynamic approach applied to the Rhône delta (southern France). Science of the Total Environment 595:787–800.



